酵素こうそenzyme(エンザイム)
我々人間の体内には約5000種類もの酵素が存在しているとされており、このそれぞれが体を健康に保つために働いています。もちろん、他の植物、動物、微生物においても同様に様々な酵素が化学反応を起こすことで生命サイクルが循環されています。
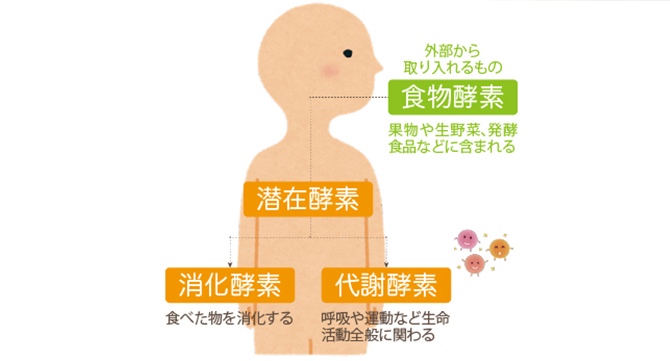
この酵素群は大きく「消化酵素」と「代謝酵素」に分類されます。
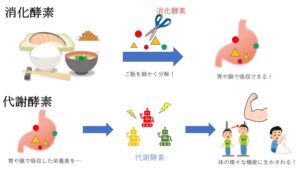
消化酵素は食事などで体に取り入れた物質を消化・吸収できるように分解する役割を持ちます。
一方、代謝酵素は消化酵素によって吸収された栄養素を生命活動に必要なエネルギーに変える、体の機能を維持するなどの体内の化学反応全般を担う役割を持ちます。
この二者の酵素が揃うことで初めて人間の体は調子良く動くわけですね。
日本酒で例えると、麹が生産するデンプン分解酵素(アミラーゼ/消化酵素)がデンプン(食事)をグルコース(単糖/栄養素)に分解。
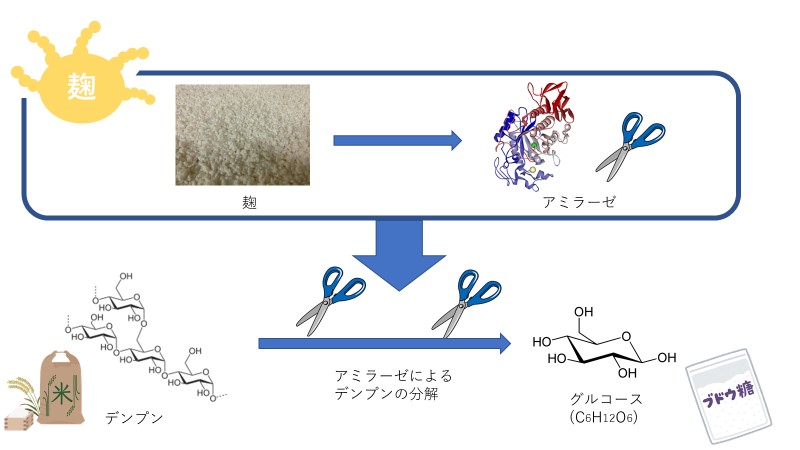
分解されたグルコース(単糖/栄養素)は酵母のピルビン酸カルボキシラーゼ、アルコールデヒドロゲナーゼ、チマーゼ他複数の酵素(代謝酵素)によって酵母の生命サイクルに用いられ、その副産物としてエタノールが生産されます。
また酵素には老化を防ぐ、免疫力を高めるなどの効果もあるので、老化の進行を抑えるという役割も併せ持つことになります。
しかし、この大切な酵素、体の中で作られる量が決まっています。加えて齢を重ねるごとにその合成量は減っていきますので、植物や動物、そして微生物で合成される酵素を食事などで外から取り入れることが重要となります。
これが、昨今のアンチエイジングや若返りなどに「酵素を摂取するとよい」と言われる由縁なんです。
食品中に含まれる酵素は消化酵素がメインです。これを食事で補えば、人間の体内は代謝酵素の生産に専念でき、貴重な酵素の上限を有効活用できるのです。
酵素(読み)こうそ(英語表記)enzyme
1752年にフランスのR・F・レオミュールは、鳥の胃液が肉を溶かすのをみつけ、生体内の反応が生体外でもおこりうることを示した。1833年にJ・F・ペルソーとA・ペイアンが、麦芽からデンプンを分解する成分を取り出し、ジアスターゼと名づけた。これが酵素を物質としてとらえた最初である。やがて胃液からはペプシンが、その他の臓器からもいろいろな消化酵素がみつけられた。1878年にドイツの生理学者キューネWilhelm Kühne(1837―1900)は、このように生体外に取り出せる酵素をエンチームEnzym(ドイツ語)と名づけた。消化酵素以外では、1894年にフランスの生化学者G・E・ベルトランが酸化酵素を、1898年にE・ブフナーがアルコール発酵を行う酵素(群)をみつけ、生物の行う化学反応のほとんどに酵素が関係していると信じられるようになった。1926年にJ・B・サムナーがウレアーゼの結晶化に成功し、それがタンパク質であることを確認した。
第二次世界大戦以後、酵素の構造研究は飛躍的に進み、1963年にアメリカの生化学者W・H・スタインとS・ムーアらがウシ膵臓(すいぞう)のリボヌクレアーゼのアミノ酸配列を完全に決定し、1965年にはイギリスのフィリップスDavid Chilton Phillips(1924―1999)らが、X線解析法によって卵白リゾチームの立体構造を明らかにした。また1980年(昭和55)には当時の京都大学薬学部教授の矢島治明(やじまはるあき)と助教授藤井信孝(ふじいのぶたか)(1950― )が、ウシ膵臓リボヌクレアーゼの完全化学合成に成功した。
[笠井献一]
種類目次を見る
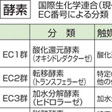
細菌のような簡単な生物でさえも1000種類以上の酵素を必要とするから、全生物界に存在する酵素の種類は膨大なものとなる。これを合理的に分類整理するために1961年、国際生化学連合(現在は国際生化学・分子生物学連合)が分類命名法を提案した。これは分類の基礎を、酵素が触媒する化学反応の型に置いている。大まかに六つの群に分け、それがさらに細分されている()。研究が進むにつれて、予想もしなかったような作用をもつ酵素がみつかったりするので、現在でもときどき修正される。
[笠井献一]
化学的・物理的性質目次を見る
酵素はごく一部の例外を除いて、単純タンパク質または複合タンパク質の高分子であるから、化学的・物理的性質はタンパク質の性質がそのまま当てはめられる。分子量は小さいもので約1万(アミノ酸として約100個)、大きいものでは10万(アミノ酸として約1000個)以上のものもあるが、数万程度のものがもっとも多い。ある種の酵素では、タンパク質以外の低分子化合物が存在しないと触媒作用を行えないものがある。このような低分子物質を補酵素または補欠分子族という。例外的ではあるが、ある種のRNA(リボ核酸)が触媒作用をもつことが発見されており、これらはリボザイム(リボはRNA、ザイムはエンザイムの語尾)とよばれている。
[笠井献一]
分離と精製目次を見る
酵素を得るには生物あるいは生物の生産物を原料とする。分離精製法はタンパク質の場合と本質的には変わらないが、酵素はとくに不安定なため、低温、中性の水素イオン濃度(pH)で取り扱うなど、細心の注意を払わなければならない。高温、強い酸やアルカリ、有機溶媒などにさらされると酵素タンパク質が変性し、触媒能力が失われて元に戻らなくなる危険性が大きい。最近は、酵素が基質に似た物質によく結合することを利用したアフィニティ(親和力)クロマトグラフィー法が発達してきたので、短時間で能率よく純化できるようになった。今日では純化されている酵素は多数に上り、さまざまな分野で役だっている。
[笠井献一]
酵素の生合成目次を見る
生物の体内では、酵素も普通のタンパク質とまったく同じやり方で合成されている。その生物のもっているすべての酵素のアミノ酸配列は、遺伝子であるDNA(デオキシリボ核酸)に記録されており、必要なときに必要な酵素が合成されるよう巧みに制御されている。
[笠井献一]
酵素の役割目次を見る
生物が生きていくためには、無数の化学反応を一瞬の休みもなく続けていなければならない。ところが化学反応というものは、生物の細胞が生きている環境、すなわち40℃以下の温度、水という溶媒、中性のpHなど、いわゆる穏やかな条件下では、非常に進行しにくいものである。生物体内で行われている化学反応のうちのかなり単純なものでさえ、試験管内でまねるのはやさしくない。たとえば、胃の中で毎日行われているタンパク質の消化(加水分解)を酵素なしで試験管内で行わせるのはたいへんである。胃液に含まれるよりも100倍も濃い塩酸の中で、一昼夜も100℃くらいに熱し続けなくてはならない。ましてや生体成分の合成のように複雑な化学反応を試験管内で完璧(かんぺき)にまねることなど不可能である。ところが生物では、無数の複雑な化学反応が互いに組み合わさりながら、みごとな秩序をもって、すばやく進行している。このようなことができるのは、一つ一つの化学反応が、それぞれきちんと定められた酵素によって導かれているからである。
酵素の触媒作用を受ける物質を基質、その反応によってつくりだされる物質を生成物とよぶ。酵素は化学反応の手助けをするが、自分自身は変化しないので、何回でも繰り返して働くことができる。したがって基質よりはるかに少ない量さえあればよい。基質が生成物に変わるという化学反応がおこるためには、基質がいったん変化途中の不安定な状態にならなければならない。この状態に到達するにはエネルギーが必要であり、それを活性化エネルギーという。この活性化に必要なエネルギーが大きいほど反応はおこりにくいことになる。酵素は、ほんの小さなエネルギーさえあれば、基質がこの中間状態に到達できるよう手助けする。これを活性化エネルギーを低下させるという。たとえていえば、基質から生成物へと変わるには、高いエネルギーの山を越えていかねばならないところを、酵素はトンネルをつくってすばやく向こう側へ行かせるのである。これによって化学反応は短い時間で平衡状態に到達できる。この性質は一般の触媒と同じであって、基質と生成物の量が平衡状態に到達したら、それ以上反応を進めることはできないが、酵素にはそのほかにも以下に述べるようなさまざまな優れた特性があり、酵素に匹敵するような触媒はほかにはなく、人工的につくられてもいない。
[笠井献一]
酵素の特色目次を見る
(1)酵素は効率がよい。たとえばカタラーゼがあれば、1分間に500万分子の過酸化水素が分解される。鉄の錯塩のあるものもこの反応を触媒できるが、分解速度は1分間に10万分子くらいである。
(2)特異的である。酵素が触媒しうる化学反応は厳重に決められている。たとえばキモトリプシン、トリプシンなどは、タンパク質の加水分解反応なら触媒するが、デンプンや脂肪の加水分解はまったく触媒しない。タンパク質の加水分解についても、キモトリプシンとトリプシンでは役割が違い、分解されるペプチド結合が異なっている。またこれらの酵素はL型のアミノ酸からなるペプチド結合だけを分解し、ラセミ化のような副反応もおこさない。このように酵素の基質、生成物、反応形式などが厳重に決まっているため、細胞内では複雑な反応が間違いなく、整然と行われるのである。これは酵素分子が、決まった基質とだけ結合する性質をもっていて、その物質だけが触媒作用を受けられるからである。
(3)酵素の作用は調節できる。酵素の触媒能力は、いろいろの条件で強められたり弱められたりする。たとえば、生成物が十分につくられ、もはやそれ以上必要なくなると、酵素の能力が抑えられる。逆にある物質が欠乏したときには、ホルモンなどの作用により必要な酵素が活性化され、その物質を速やかに合成する。
(4)至適温度(最適温度)をもつ。酵素に触媒される反応でも温度が上がれば反応は速くなるが、普通は40℃を超えるあたりから、むしろ反応が遅くなる。これは、酵素がタンパク質であり、熱に弱く、立体構造が壊れて、酵素としての能力が失われてしまうからである。反応がもっとも速くなる温度を、その酵素の至適温度という。
(5)至適pH(最適pH)をもつ。酵素の作用の強さはpHによって変わる。もっとも作用の強いpHを至適pHという。普通は7付近の中性である。しかし胃の中のように強い酸性の環境下で働く消化酵素ペプシンは、至適pHが2くらいであり、その目的によくかなっている。
[笠井献一]
酵素の作用機構目次を見る
以上のような酵素の特色は、すべてタンパク質分子としての酵素の構造に由来している。今日ではかなりの酵素の立体構造がわかっているので、どのようにして触媒作用が行われるのか、かなり詳しく推定できるようになった。酵素分子には、さまざまな役割を受け持つ部位がある。そのうちでいちばん重要なのは活性部位である。これのおもな役割は二つある。一つは基質を正しく抑え込むこと(特異的基質結合)、もう一つは化学反応の進行を手助けすること(触媒作用)である。これらが実際にどのように行われるかは、酵素の種類によって千差万別であるが、例としてタンパク質加水分解酵素であるキモトリプシンについて説明しよう。
キモトリプシンはアミノ酸が二百数十個つながった分子量約2万5000のタンパク質である。大ざっぱな形は球に近い。分子の一部(の正面中央)にくぼみがあり、ここが活性中心である。これをわかりやすいように図式化すると、基質結合部位と触媒部位に分けることができる()。この酵素は、基質となるタンパク質中にフェニルアラニン、チロシン、トリプトファン(いずれも側鎖に芳香環を含む)がある場合に、そのカルボキシ(カルボキシル)側のペプチド結合を加水分解する。したがって芳香族アミノ酸に特異的である。その理由は、活性部位のなかでさらに深く彫り込まれた洞穴状の基質結合部位があり、そこにこれらのアミノ酸の芳香環がぴったりはまるからである。この洞窟を基質結合ポケットという。したがって基質となるタンパク質は芳香族アミノ酸の所で活性部位に固定される。これら以外のアミノ酸の所では固定されない。固定されて初めて触媒作用を受けられるようになる。加水分解()はペプチド結合R1-CO-NH-R2の間に水H2Oが1分子入ってR1-COOHとH2N-R2のように切り離す反応であるが、水分子が直接にこの結合を攻撃しても手に負えない。そこで触媒部位が手助けする。ここで主役を演じるのが、触媒部位にある特別なセリンである。セリンの側鎖には水と構造の似たヒドロキシ基(OH基)があるが、この特別なセリンのヒドロキシ基は水よりも結合を切断する力がはるかに強い。これがCO-NH結合を攻撃してまず切り離し、そのあとで水分子に手渡すのである。触媒作用を完了した後は、酵素自体にはなんの変化も残らないので、最終結果だけをみれば、水がペプチド結合を切ったことになるが、酵素の助けがなければ腸内のような穏やかな環境ではおこりえなかったことである。キモトリプシンによく似たタンパク質にトリプシンがある。この二つの酵素は立体構造もそっくりであるが、トリプシンは基質タンパク質のなかで、リジンやアルギニンのある位置に限って切断する。基質結合ポケットの形が、リジンやアルギニンのように側鎖に正電荷をもつアミノ酸をぴったりとはめ込むからである。このように酵素の特異性は、おもに基質結合部位の性質から理解することができる。
[笠井献一]
酵素の利用目次を見る
さまざまな分野で、生物から取り出した酵素が利用されている。原料としては、動物、植物も使われるが、細菌やカビなどの微生物が、短時間で増やすことができ、目的酵素をたくさんつくる品種(菌株)を得やすいなど、有利な点が多い。最近では、遺伝子工学によって、人間などの酵素を微生物に生産させることも行われている。酵素の利用例をいくつかあげる。
(1)有用有機物質の生産。有機合成技術が今日のように進歩しても、生物に由来するものを使うほうが圧倒的に有利な場合が多い。そこで生物に材料を求め、それを酵素で目的物につくりかえることは盛んである。たとえばデンプンはグルコース(ブドウ糖)の重合したものであるから、加水分解さえすればグルコースが得られる。これには酸やアルカリを使うより、微生物からとれるデンプン加水分解酵素を使うほうがはるかに有利なので、工業的に行われている。またアミノ酸などは、化学合成では目的とするL体以外に、不必要な光学異性体であるD体までできてしまうが、それを除去するのにも酵素が利用されている。チーズをつくるには牛乳を凝固させるのが第一段階で、その際子ウシの胃に含まれるキモシン(レンニン)という酵素が使われるが、これには供給に限りがある。そこで最近は、同じ作用をする酵素を微生物から得て使っている。
(2)医薬品として。病気の治療のために欠乏している酵素を与えたり、殺菌作用がある酵素を与えると効果がある。心筋梗塞(こうそく)や脳血栓は、血管内に血栓ができて詰まるのが原因であるが、ウロキナーゼというタンパク質分解酵素を注射すると治療できる。これは、血液中にもともと存在していて、血栓を溶かすのが本来の役割であるプラスミンという酵素の働きを強めるのである。炎症を鎮めるために、病原菌を溶かすリゾチーム、膿(うみ)などを分解して除去するタンパク質分解酵素なども使われている。消化不良の治療には、デンプン分解酵素であるタカジアスターゼ、いろいろな消化酵素の混ざったパンクレアチンなどを飲ませると効果がある。
(3)基礎科学の研究手段として。タンパク質、核酸、多糖など、生物にとって重要な役割を果たしている高分子物質の構造を調べるには、酵素はなくてはならない試薬である。いろいろな特異性をもつ分解酵素で、これらの高分子を壊し、取扱いに手ごろな大きさにするのが研究の第一段階である。酵素が使えなかったら、生命科学の進歩は、いまよりもはるかに遅れていたであろう。
(4)遺伝子操作のための手段として。今日、急速に進歩している遺伝子操作でも、酵素は欠かすことのできない武器である。目的のDNAを取り出したり、切ったり、つないだり、ほとんどの操作が酵素の助けを借りている。1970年から1980年にかけて、いろいろな酵素がみつかったからこそ、遺伝子操作が始まったといってもよい。
(5)その他。まださまざまな利用法がある。たとえば糖尿病の治療のためには、血液中のグルコース量を頻繁に測定しなければならないが、その一つの方法として、グルコース酸化酵素を利用するものがある。そのほか、酵素の特異性を利用したさまざまな臨床検査法がある。また近年、環境保全の立場から洗濯用の洗剤にリン酸を加えるのを避けるようになってきたが、それによる洗浄力の低下を補うために、微生物由来のタンパク質分解酵素を添加したものが広く使われるようになっている。
[笠井献一]
酵素異常目次を見る
生体内の酵素を含むタンパク質の合成は遺伝子の情報によって行われるが、遺伝子の異常によって一つの酵素が欠損すると、そこで代謝がブロックされ、中間代謝産物が増加して先天性代謝異常をおこす。代表的な疾患にフェニルケトン尿症やアルカプトン尿症などがある。また、酵素異常によって正常と異なる分子構造をもつようになる分子病の解明など、分子生物学上でも注目されている。
[笠井献一]
食品目次を見る
食品加工には酵素の作用を利用したものが多いが、その大部分は微生物の酵素によっている。最近、酵素そのものを食品に応用することも行われている。微生物の酵素を利用した食品には、醸造酒、食酢、みそ、しょうゆ、納豆、パン、チーズ、ヨーグルト、かつお節、漬物などがある。醸造酒に利用される主要な酵素系はアミラーゼとチマーゼである。前者は麹(こうじ)または麦芽(ばくが)、後者は酵母により供給されており、清酒は米麹と酵母、ビールは麦芽と酵母の組合せによってつくられる。食酢は酢酸菌を、みそは米麹を、しょうゆは麹菌を、納豆は納豆菌を、パンはパン用酵母を用い、菌のもつ酵素を利用している。チーズは子牛の第4胃より分泌されるキモシンという酵素および乳酸菌を利用し、ヨーグルトは乳酸菌を利用してつくられる。最近は微生物から酵素を抽出、精製した酵素剤がつくられ、これを食品加工に応用することが行われている。
[宮崎基嘉]
『今堀和友他著『現代化学シリーズ51 酵素分子』(1973・東京化学同人)』▽『船津勝編『酵素』(1976・講談社)』▽『徳重正信著『酵素のはたらき』(1988・東京大学出版会)』▽『H・デュガス著、井本泰治・山田秀徳・植田正訳『生物有機化学――酵素作用への化学的アプローチ』(1993・シュプリンガー・フェアラーク東京)』▽『一島英治著『酵素の化学』(1995・朝倉書店)』▽『西沢一俊・志村憲助編『新・入門酵素化学』改訂第2版(1995・南江堂)』▽『藤本大三郎著『酵素反応のしくみ――現代化学の最大の謎をさぐる』(1996・講談社)』▽『大野惇吉著『酵素反応の有機化学』(1997・丸善)』▽『一島英治著『酵素――ライフサイエンスとバイオテクノロジーの基礎』(2001・東海大学出版会)』▽『相沢益男著『最新酵素利用技術と応用展開』(2001・シーエムシー出版)』▽『宍戸和夫著『分子遺伝子のための核酸酵素テキストブック』(2004・コロナ社)』

酵素の分類〔表〕

キモトリプシンの立体構造モデル〔写真〕
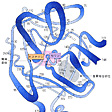
ウシ・キモトリプシンの概念図〔図A〕
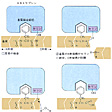
キモトリプシンの加水分解〔図B〕
化学辞典 第2版「酵素」の解説
酵素
コウソ
enzyme
(1)常温,中性という緩和な条件で化学反応を触媒する,
(2)基質特異性がきわめて高い,
(3)触媒効率が大である,
という特徴を有する.現在までに約1000種類の酵素が発見され,1926年,J.B. Sumner(サムナー)によってウレアーゼが結晶化されて以来,約150種類が結晶化されている.酵素によって触媒される化学反応を分類すると,
(1)酸化還元反応,
(2)転移反応,
(3)加水分解反応,
(4)脱離反応(リアーゼ),
(5)異性化反応,
(6)合成反応,
である.酵素はいずれもタンパク質であるが,タンパク質のみで機能を発現するものと,タンパク質と低分子化合物が結合して機能を発現するものとがある.その低分子化合物を補酵素あるいは補欠分子族といい,ニコチンアミドアデニンジヌクレオチド(NAD)およびそのリン酸塩(NADP),ビタミン B2,B6,B12,フラビンモノヌクレオチド(FMN),フラビンアデニンジヌクレオチド(FAD),ヘム,銅,亜鉛などがある.各種酵素タンパク質のアミノ酸組成,分子量などの物理化学的性質,タンパク質としての一次,二次,三次,四次構造が解明され,さらにX線回折による研究より立体構造のモデルが提唱されている.酵素の命名は既知酵素の数が増大した現在,混乱を避けるため,国際生化学連合の提案した系統名が用いられつつあるが,日常の便宜のため常用名も使用されている.たとえば,常用名でアルコールデヒドロゲナーゼはアルコールを脱水素してアルデヒドにし,同時にNADを還元する反応を触媒する酵素であり,系統名ではアルコール:NADオキシドレダクターゼといい,EC番号(酵素番号)はEC 1.1.1.1である.
出典 森北出版「化学辞典(第2版)」化学辞典 第2版について 情報
百科事典マイペディア「酵素」の解説
酵素【こうそ】
→関連項目アイソザイム|アデノシンデアミナーゼ|アロステリック酵素|ウィルシュテッター|γ-GTP|サムナー|GOT|GPT|触媒|生合成
出典 株式会社平凡社百科事典マイペディアについて 情報
栄養・生化学辞典「酵素」の解説
知恵蔵「酵素」の解説
酵素
(垂水雄二 科学ジャーナリスト / 2007年)
出典 (株)朝日新聞出版発行「知恵蔵」知恵蔵について 情報
精選版 日本国語大辞典「酵素」の解説
こう‐そ カウ‥【酵素】
出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報
ブリタニカ国際大百科事典 小項目事典「酵素」の解説
酵素
こうそ
enzyme
出典 ブリタニカ国際大百科事典 小項目事典ブリタニカ国際大百科事典 小項目事典について 情報
デジタル大辞泉「酵素」の解説
生活習慣病用語辞典「酵素」の解説
出典 あなたの健康をサポート QUPiO(クピオ)生活習慣病用語辞典について 情報
世界大百科事典 第2版「酵素」の解説
こうそ【酵素 enzyme】
出典 株式会社平凡社世界大百科事典 第2版について 情報
世界大百科事典内の酵素の言及
【酵素工業】より
【タンパク質(蛋白質)】より
【補酵素】より
【誘導酵素】より
※「酵素」について言及している用語解説の一部を掲載しています。